东南大学刘妍教授、顾忠泽教授团队在《ACS Nano》期刊发表文章“Artificial Meshed Vessel-Induced Dimensional Breaking Growth of Human Brain Organoids and Multiregional Assembloids”,该研究采用双光子激光直写技术(TPP)来制造高分辨率网状血管。这些血管由光刻胶制成,其侧壁有密集分布的直径为20 μm的微孔,与脑类器官共培养,以促进培养基向类器官扩散。血管化的类器官表现出维度断裂生长和增殖增强,缺氧减少和提示3D打印的网状血管部分模拟血管功能,促进类器官的培养。此外,皮质、纹状体和内侧神经节隆起(MGE)类器官分别通过3D打印血管分化生成皮质-纹状体-MGE组合物。在组装体的不同脑区域类器官之间观察到增强的迁移、投射和兴奋性信号转导。该研究提出了一种利用TPP 3D打印技术构建血管化脑类器官和组装体的方法,以增强其开发和组装,为神经系统疾病的研究提供了一个模型和平台。

WHAT—什么是双光子激光直写技术(TPP)?
双光子激光直写技术(TPP),是一种基于激光光束的三维纳米打印技术。TPP 3D打印技术利用双光子吸收效应,即物质在特定条件下能同时吸收两个光子,从而引发聚合反应。这种非线性效应需要使用高功率、短脉冲的激光器,如飞秒激光器。在TPP过程中,激光束聚焦在光敏聚合物溶液中的特定位置,形成一个微小的聚合区域。当两个光子的能量同时被吸收时,光敏聚合物中的单体发生聚合反应,形成聚合物链。通过移动激光束或调整光敏聚合物的位置,可以在三维空间内精确打印出复杂的结构。
WHY—双光子激光直写技术用于该研究的优点?
3D打印是一种先进的技术,可以制造具有复杂结构和功能的生物结构,与天然组织非常相似。3D打印可以实现高通量生产,并生成所需的流腔结构,用于3D环境中的任何培养基。尽管3D打印技术取得了重大进步,但在血管结构中创建100 μm或更小的微孔的挑战仍然存在。双光子激光直写技术(TPP) 3D打印技术,一种基于激光直写(LDW)的光辅助打印方法,作为一种解决方案已经出现。TPP能够实现高分辨率,超越衍射极限,使其能够在3D管状结构中打印复杂的微孔图案,用于模拟微尺度血管系统。然而,TPP 3D打印尚未应用于脑类器官。因此,TPP 3D打印策略可能成为实现血管化脑类器官和组装体的解决方案。
HOW—使用TPP技术打印血管,与脑类器官共培养,以促进培养基向类器官扩散
类器官的主要瓶颈之一是类器官在长期培养过程中变大,由于营养供应不足,导致类器官中心区域形成坏死核心。而3D打印网状血管改善了脑类器官坏死核的形成过程。
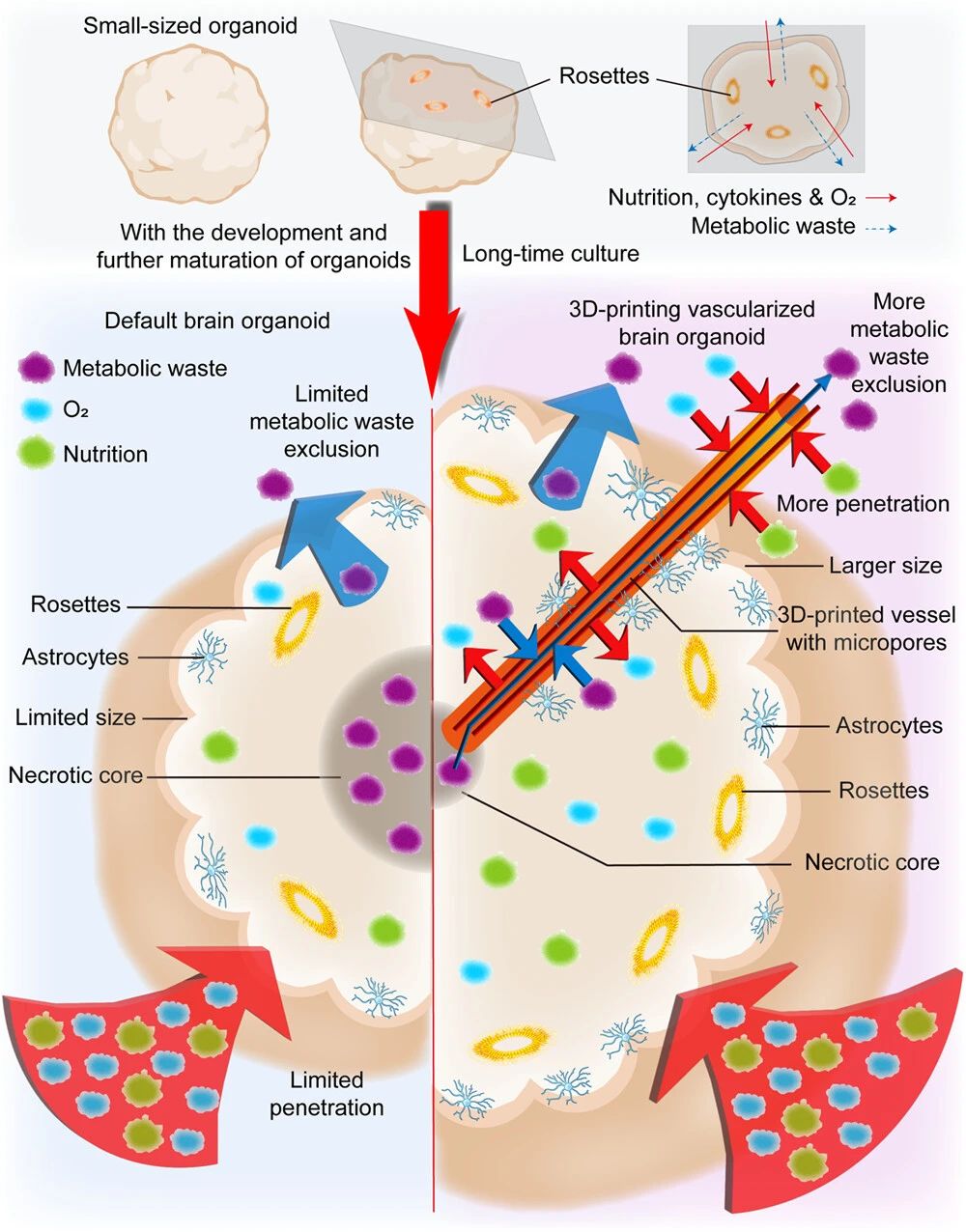
图1 3D打印血管化脑类器官方案概念图
作者团队首先通过多物理场模拟软件模拟了3D打印血管对培养基向类器官扩散的影响。根据模拟结果,作者团队优化了3D打印血管的设计方案和大小,以符合人脑微血管的网格特征(图2a),并通过TPP 3D打印将其制成光刻胶用于类器官培养。
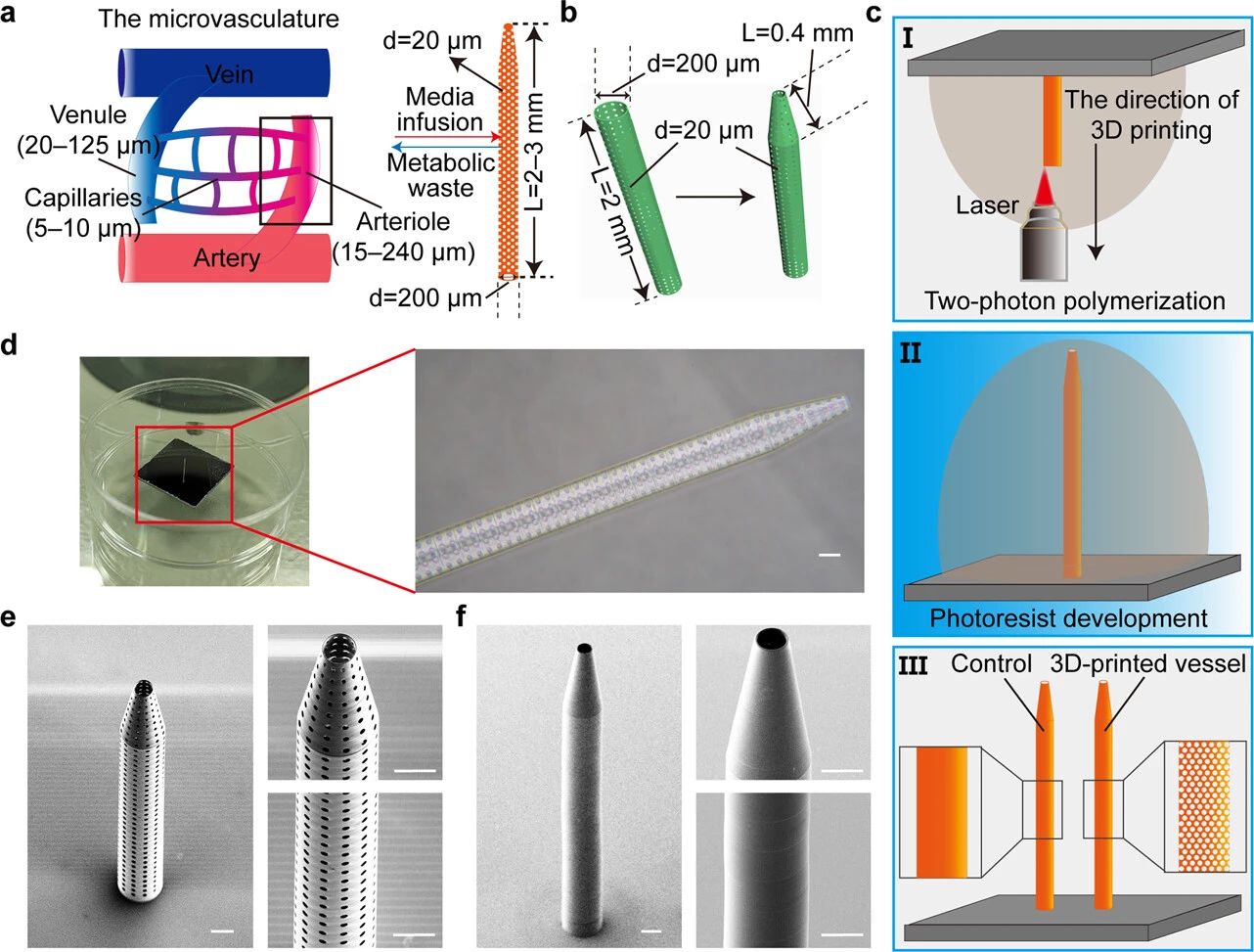
图2 3D打印容器的制造和表征
作者团队修改了先前报道的脑类器官生成方案(图3a),在第7天将hPSC衍生的脑类器官嵌入Matrigel中,以促进神经上皮细胞的形成。在培养第30天时,开始将3D打印血管和对照血管与脑类器官共培养,以便于培养基的灌注使类器官血管化(图3a)。在整个培养期间,对比默认类器官组和对照组,血管化的类器官的大小明显增加(图3b)。作者团队通过免疫荧光染色进一步研究了3D打印网状血管是否影响类器官生物标志物的表达,对具有3D打印血管的类器官进行组织学分析(图3),结果表明3D打印血管周围细胞生长良好,表明3D打印血管与脑类器官具有生物相容性。作者团队还通过免疫荧光染色检测3D打印血管在长期培养中的生物相容性(图3k),结果表明血管化类器官在长期培养中仍具有增殖能力。作者团队还在3D打印血管周围和血管化脑类器官的侧区观察到GFAP阳性的星形胶质细胞。值得注意的是,在血管化的类器官中,观察到星形胶质细胞在3D打印血管壁上排列,并且倾向于具有与天然血管周围星形胶质细胞相似的排列(图3m)。综上所述,作者团队生成了3D打印血管化的类脑器官,并发现在类脑器官中长期培养后,生物相容性3D打印血管显示出与天然血管相似的结构。
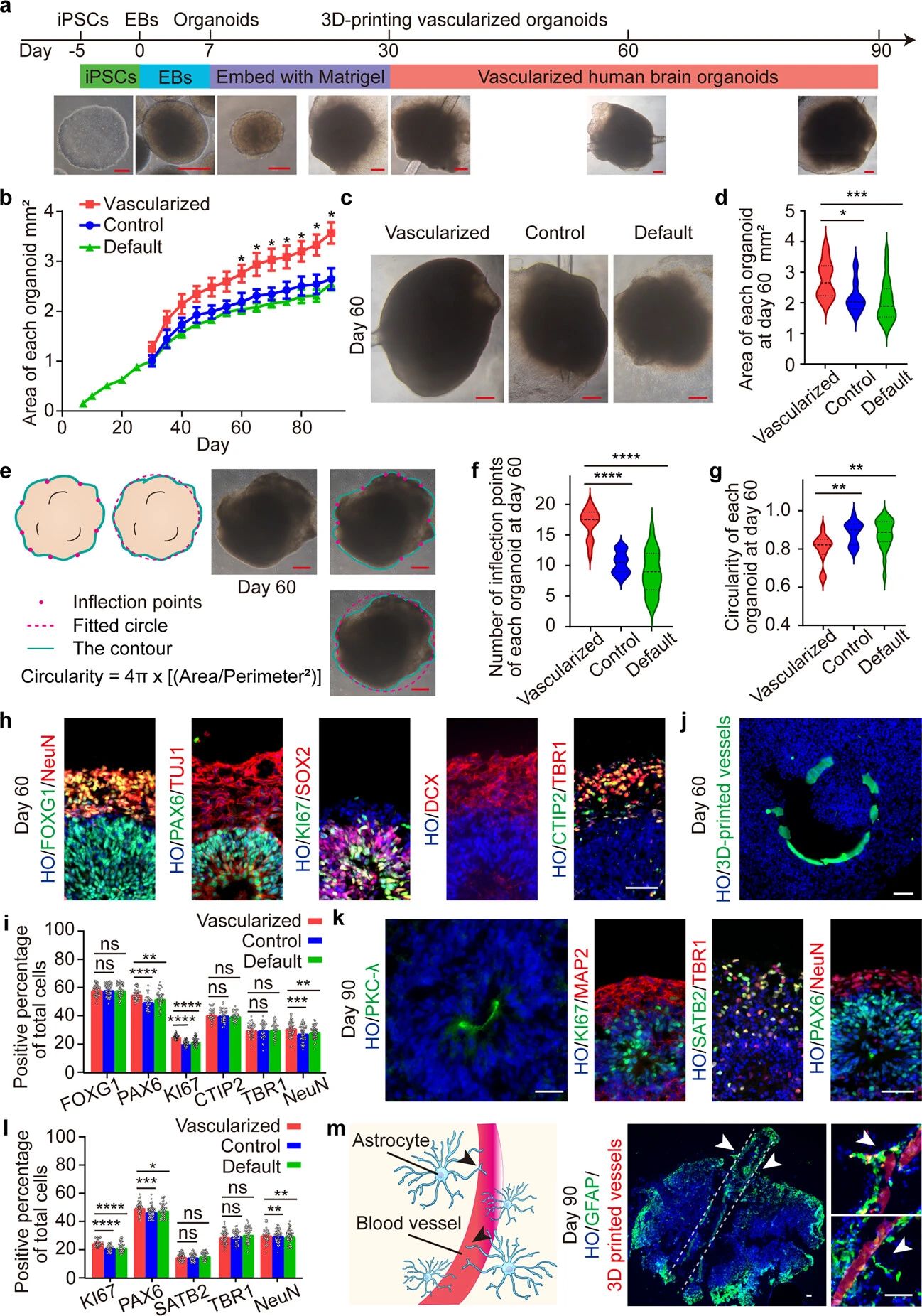
图3 3D打印血管化脑类器官的生成
为了确定3D打印血管是否使培养基能够渗透到脑类器官中,作者团队将90天的类器官暴露于荧光示踪剂FITC-葡聚糖中2小时(图4a)。图4b,c结果表明3D打印血管可以使培养基扩散到脑类器官的核心,这可能建立了营养物质的运输途径。作者团队还检测了血管化脑类器官的缺氧、增殖和凋亡,以确定3D打印血管是否可以增加血管化脑类器官的大小并减少细胞凋亡,结果显示3D打印血管化类器官的尺寸显著增加(图3b,d)。作者团队在含有Hypoxyprobe-1的培养基中培养类器官2小时,结果发现3D打印血管可以改善脑类器官内的供氧(图4d, e)。然后分析了类器官内的细胞凋亡,通过TUNEL染色,作者团队观察到血管化的类器官中每单位面积的凋亡细胞数量显著减少,还发现了长期培养的血管化类器官,增殖标记物K16的表达增加。这些结果表明3d打印血管通过改善缺氧改善脑类器官的增殖和减少细胞凋亡。
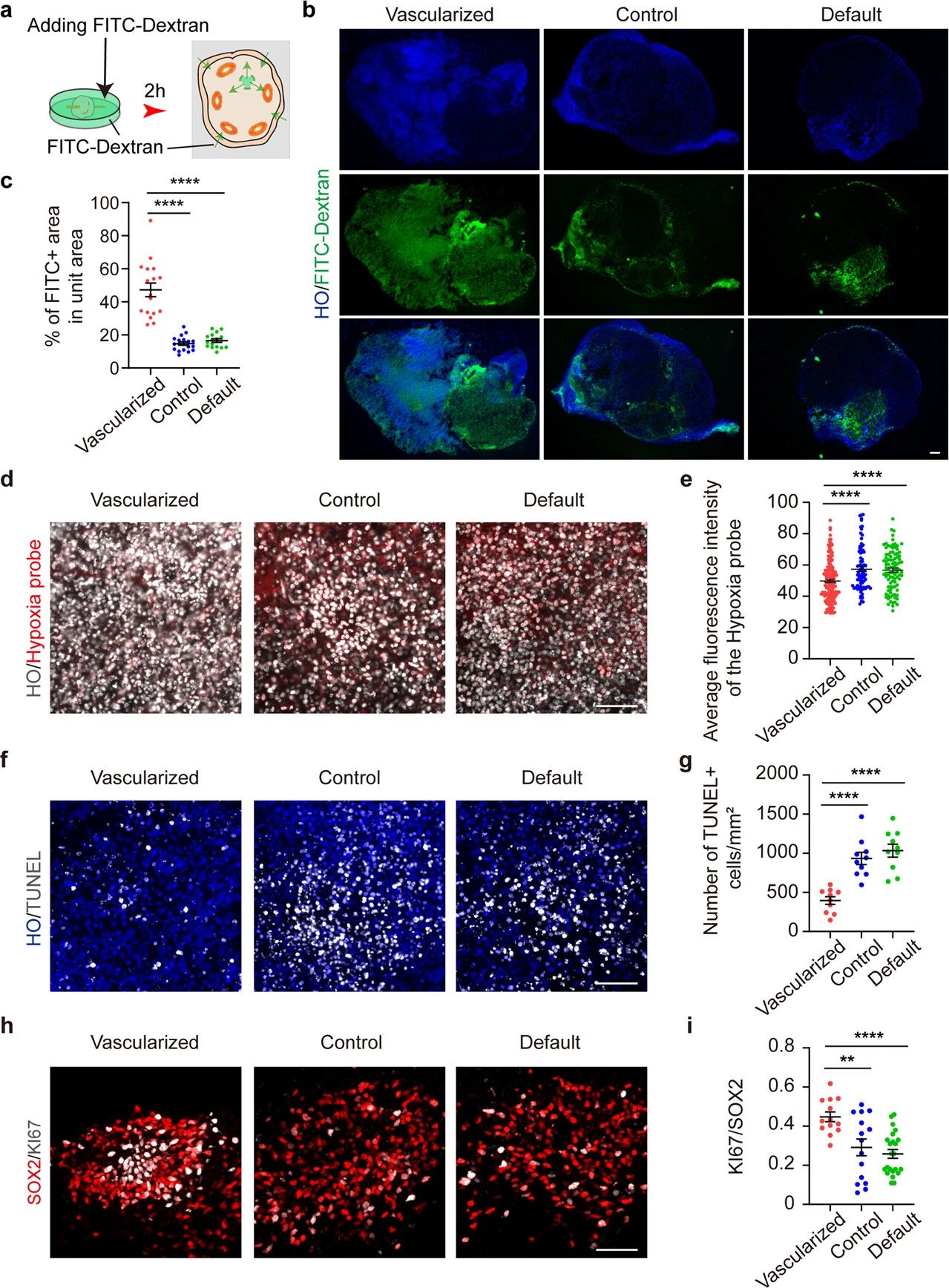
图4 长期培养3D打印血管化类器官的生物学特性
为了进一步探讨血管化脑类器官的功能,作者团队在第90天通过将钙指示剂Fluo - 4 AM加载到细胞上对脑类器官进行钙成像评估(图5a)。研究结果表明,在血管化的类器官中,Ca2 (Fma-Fo)/F的峰值更高(图5b, c)。此外,作者团队实施了膜片钳来记录第70-80天类器官在电流钳下的动作电位(AP)和电压钳下的钾和钠电流(图5d)。结果表明,APs在血管化的类器官中比对照组更容易被激发。这些结果证实了血管化的类器官具有更高的成熟度。作者团队还将类器官测序数据与BrainSpan数据库中人类大脑受孕后周(PCW) 8-16数据进行了比较分析。研究结果显示,在第75天分化的血管化和对照类器官都表现出与9 pcw人类大脑更接近的相似性(图5i)。在此基础上,作者团队进一步将数据与9 pcw人类大脑的各个大脑区域进行了比较,并观察到分化的对照类器官与新皮层、海马和神经节突起(GE)区域表现出更大的相似性。而血管化的类器官主要与新皮层和海马相似(图5m)。这些结果表明,在血管化脑类器官发育过程中,WNT通路的激活可能有助于观察到的腹侧分化的抑制,从而证实了之前关于3D打印血管化脑类器官的猜测。根据转录组测序结果,在3D打印的血管化脑类器官中观察到星形胶质细胞的增加。为了验证这一发现,作者团队对长时间的星形胶质细胞生物标志物GFAP进行了免疫荧光染色。培养90天的脑类器官。分析结果显示,GFAP在血管化类器官中占据的面积大于对照组和默认类器官(图5n, o)。星形胶质细胞的增加表明血管化脑类器官进一步成熟,这与转录组分析一致。
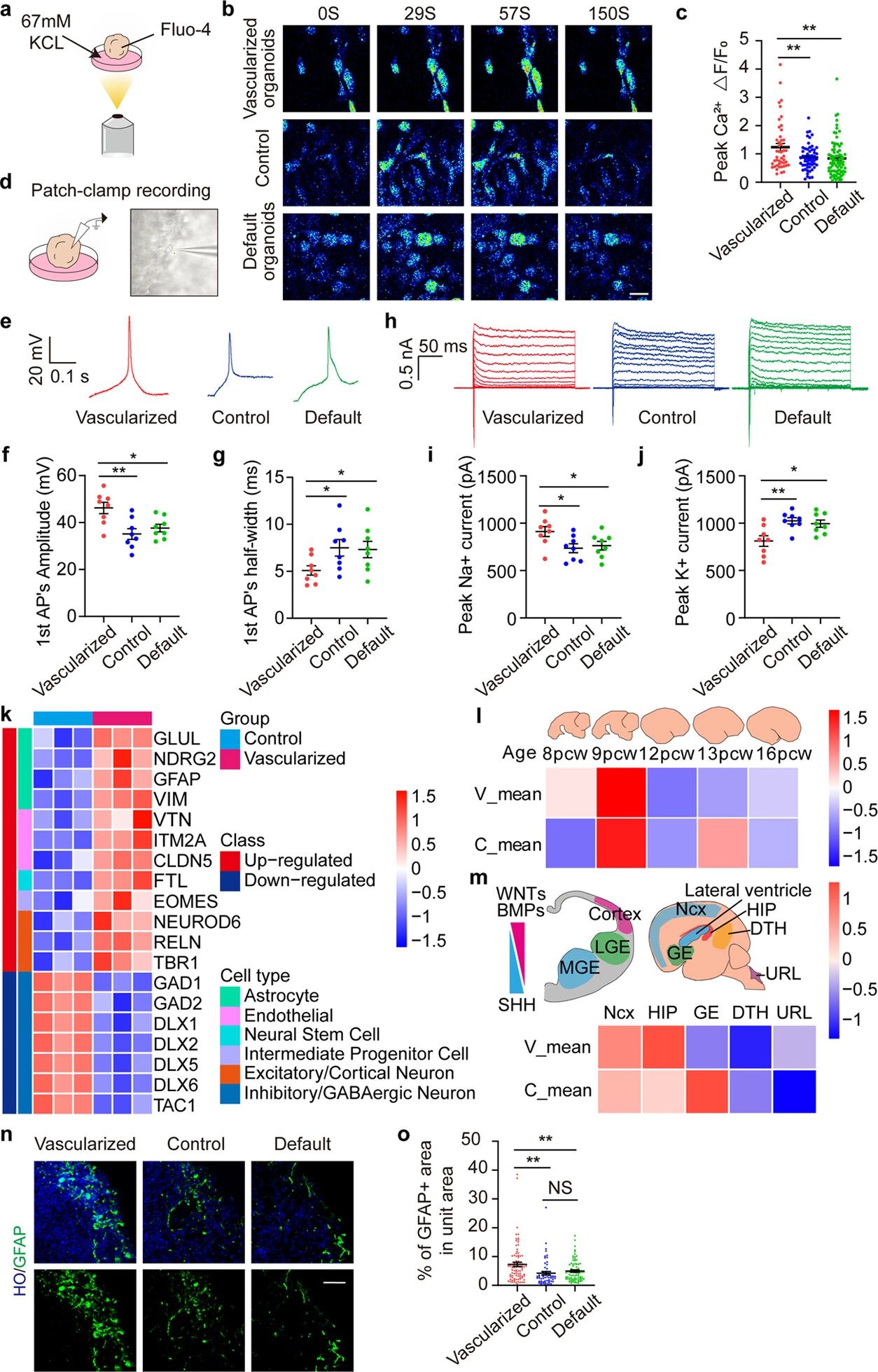
图5 3D打印血管化类器官中星形胶质细胞增加和钙信号增强
为了进一步探索3D打印网状血管的应用范围,作者团队尝试将其应用于多区域的装配体。为了解决装配体的尺寸越大,需要的营养供应也越多这一难题,作者团队开发了一种方法,利用3D打印的网状血管作为支架,生成复杂的组装体,再现了发育中的前脑的关键特征(图6a)。按照实验室之前的描述,分别生成了皮质、纹状体和MGE类器官(图6b),并使用3D打印的网状血管来引导三个脑区类器官的融合,生成血管化的组装体,以探索大脑发育中的迁移和投射(图6c)。在第45天进行免疫荧光染色以确定培养的三种类型的类器官,揭示了不同的标记表达模式。MGE产生的皮层和纹状体中间神经元最多,这些中间神经元从MGE向背皮层和纹状体切向迁移。第37天,使用3D打印的网状血管将三种类器官依次融合。在第40天,观察到细胞从hMO向hSO和hCO显著迁移(图6d-f)。血管化聚集体显示MGE细胞从hMO向hSO迁移增加(图6g,h)。从皮层到纹状体的神经投射形成皮质-纹状体回路,以调节动机行为。为了观察皮质神经元在血管化组装体中的投射,在第38天用AAV标记hCOs,通过hSyn增强剂驱动GFP表达增强,7天后用3D打印网状血管融合三种类器官。在第70天收集样本观察皮质神经元的投射,皮质神经元在血管化的组装体中广泛投射(图6i-k)。统计结果显示,与对照组相比,血管化组装体产生了更多从hCOs到hSOs的投影(图6l,m)。
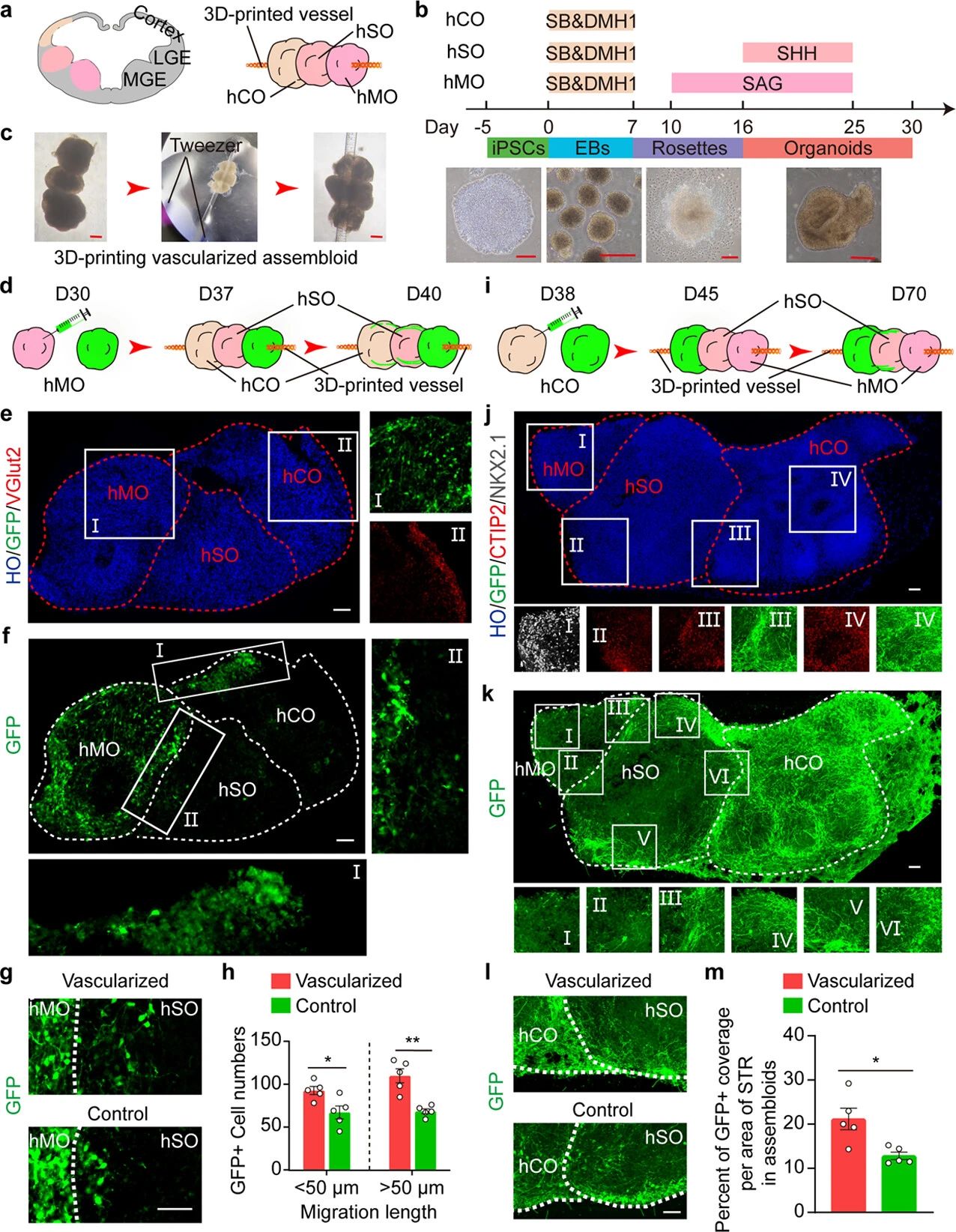
图6 3D打印血管化皮质-纹状体-MGE组装体的生成
为了进一步验证组装体在不同脑区中的兴奋性信号转导,作者团队应用了谷氨酸传感器iGluSnFR。在第45天感染纹状体-MGE、非血管化和血管化的皮质纹状体-MGE组合体(图7a-c)。研究发现,由于在第60天缺乏与大量谷氨酸能神经元融合的hCOs,在纹状体-MGE组装体中几乎检测不到谷氨酸信号。相比之下,在第60天,在非血管化和血管化的皮质纹状体-MGE组装体中,在hCOs、hSOs和hMOs中检测到丰富的谷氨酸信号(图7d),表明组装体的三个脑区有兴奋性信号转导。此外,hSOs和hMOs的iGluSnFR覆盖率增加,表明3D打印的网状血管可以促进皮质纹状体-MGE组装体的兴奋性信号转导(图7e-h)。这些发现为在3d打印网状血管引导下构建皮质纹状体-MGE组装体过程中大脑各区域之间的相互作用和交流提供了证据。总之,研究结果表明,3D打印的网状血管可以促进不同脑区域类器官在血管化组装体中的相互作用,包括细胞迁移、神经投射和兴奋性信号传导。这可能是因为它们促进了营养物质更好地进入类器官,从而调节了类组装体的代谢。
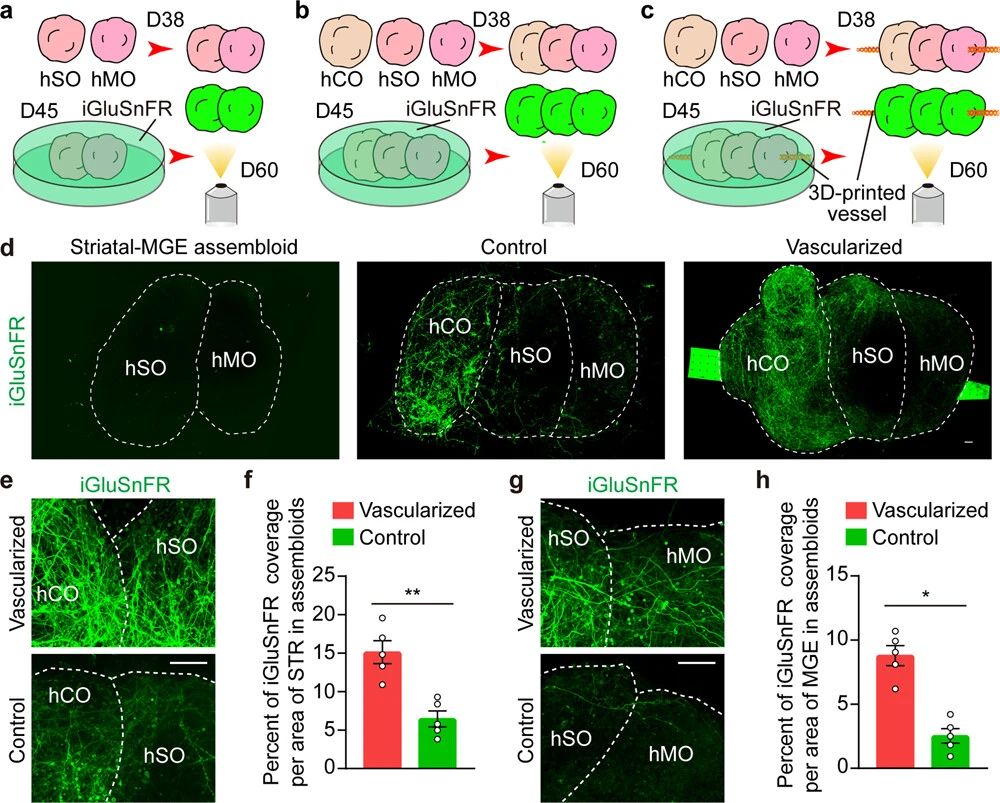
图7 促进了血管化组装体的不同脑区兴奋性信号转导
结论:作者团队利用TPP 3D打印技术成功构建了与脑类器官培养相兼容的人工网状血管。作者团队的研究表明,3D打印血管改善了脑类器官的营养供应,促进了它们的维度断裂生长和成熟,并调节了它们的细胞命运规范。更重要的是,作者团队使用3D打印的网状血管来指导和改进由hCOs、hSOs和hMOs融合而成的多区域组装体的组装。这些发现表明,3D打印的网状血管能够更好地促进脑类器官的生长和长期培养,为研究大脑发育、功能和疾病提供了一个平台。
原文链接:https://doi.org/10.1021/acsnano.4c07844